胃腸道神經(jīng)內(nèi)分泌癌的綜合基因組分析揭示了發(fā)病和發(fā)展的機(jī)制--大阪大學(xué)等
共115例神經(jīng)內(nèi)分泌腫瘤和神經(jīng)內(nèi)分泌癌的綜合基因組分析
大阪大學(xué)12月9日宣布,通過使用來自日本、美國和歐洲的樣本進(jìn)行全基因組和其他分析,闡明了胃腸道神經(jīng)內(nèi)分泌癌(NEC)的致癌機(jī)制,這是一種難治的癌癥。 這項研究是由該大學(xué)醫(yī)學(xué)研究生院和國家癌癥中心研究所基因組醫(yī)學(xué)部主任谷內(nèi)田新一教授(癌癥基因組信息學(xué))領(lǐng)導(dǎo)的一個國際研究小組進(jìn)行的。 該研究結(jié)果已發(fā)表在美國癌癥研究協(xié)會的期刊《癌癥發(fā)現(xiàn)》上。
神經(jīng)內(nèi)分泌腫瘤(NENs)是一種罕見的疾病,其免疫組化染色對神經(jīng)內(nèi)分泌標(biāo)記物(如突觸蛋白和色氨酸A)呈陽性。 根據(jù)2010年WHO的分類,NENs根據(jù)細(xì)胞增殖的程度和有絲分裂的數(shù)目被分為G1、G2或G3。 然而,由于一些G3的預(yù)后相對較好,而另一些則非常差,2019年的WHO分類首先根據(jù)組織病理學(xué)將NENs分為神經(jīng)內(nèi)分泌腫瘤(NETs)和神經(jīng)內(nèi)分泌癌(NECs)。 根據(jù)組織病理學(xué),NECs被分為小細(xì)胞型和大細(xì)胞型。 小細(xì)胞型在組織學(xué)上與小細(xì)胞肺癌相似。
由于NETs通常是通過手術(shù)治愈的,因此利用手術(shù)后的殘留標(biāo)本進(jìn)行研究,并確定了幾個致病基因,包括MEN1。 另一方面,NEC極其罕見,而且在診斷時往往伴有遠(yuǎn)處轉(zhuǎn)移,因此很少有患者適合做手術(shù),而獲得研究樣本的困難也阻礙了大規(guī)模的綜合基因組分析。 然而,研究小組對胃腸道NETs和NECs(共115例)進(jìn)行了全面的基因組分析(全基因組分析、全外顯子組分析、全轉(zhuǎn)錄組分析(RNA-seq)、甲基化分析和ATAC-seq分析),并證明兩種疾病的發(fā)病機(jī)制完全不同。 我們已經(jīng)證明,它們是兩種不同的疾病。
胰腺來源的NEC可分為導(dǎo)管型和針葉型,它們可能有不同的細(xì)胞來源
NECs按器官分為胰腺和非胰腺胃腸道來源進(jìn)行分析。 組織病理學(xué)是相似的,但基因組畸變顯示了相似性和差異性。 他們還發(fā)現(xiàn),胰腺來源的NECs以TP53和RB1基因的異常為特征,可分為 "導(dǎo)管型 "和 "針葉型"。
前者有KRAS基因的突變和胰腺導(dǎo)管細(xì)胞標(biāo)記基因(SPP1和CFTR)的表達(dá)升高。 后者沒有KRAS突變,并有一個胰腺細(xì)胞標(biāo)記基因(PTF1A)的高表達(dá)。 管狀型和針狀型NECs之間的差異可能是由于它們在胰腺中的不同細(xì)胞起源所致。 胰管型胰腺癌可能有一個共同的起源細(xì)胞,因為存在KRAS突變,這在常規(guī)胰腺癌中也是高發(fā)的,但缺乏常規(guī)胰腺癌中的大部分CDKN2A和SMAD4基因異常。有人認(rèn)為,疾病的方向可能分為正常型胰腺癌和導(dǎo)管型NEC。
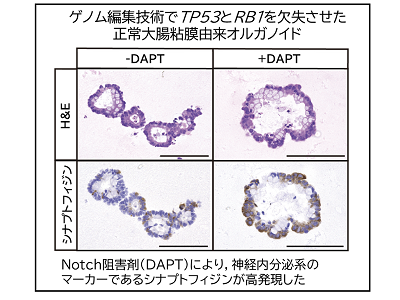
非胰腺胃腸道來源的NECs的特點(diǎn)是TP53和RB1基因或TP53和CCNE1或MYC基因的異常(相互排斥),以及大量的結(jié)構(gòu)多態(tài)性。 非胰腺胃腸道來源的NECs也以Notch基因家族的異常為特征。 事實(shí)上,我們用來自結(jié)腸粘膜的器官驗證了抑制Notch信號會誘導(dǎo)突觸蛋白陽性細(xì)胞,這是一種神經(jīng)內(nèi)分泌的標(biāo)記。
與非胰腺胃腸道來源的NECs相比,胰腺來源的NECs的五年生存率明顯較低。 此外,胃部NEC和結(jié)直腸NEC各發(fā)現(xiàn)一例是由病毒感染引起的(胃部NEC:梅克爾細(xì)胞多瘤病毒,結(jié)直腸NEC:人類乳頭瘤病毒)。 在這種病毒性致癌中,沒有觀察到TP53和RB1基因的異常。
由于啟動子甲基化,轉(zhuǎn)錄因子SOX2/ASCL1在NEC高度表達(dá)
研究人員還發(fā)現(xiàn),NECs的一個主要特征是SOX2和ASCL1的高表達(dá),這兩個轉(zhuǎn)錄因子能調(diào)節(jié)神經(jīng)內(nèi)分泌的分化,而這是由于每個基因的啟動子區(qū)域被甲基化了。 一般來說,啟動子區(qū)域的去甲基化會導(dǎo)致基因表達(dá)的增加,但最近也有相反的報道。 此外,ATAC-seq分析顯示,在SOX2高表達(dá)的NECs中,SOX2周圍區(qū)域具有開放的染色質(zhì)結(jié)構(gòu),即基因轉(zhuǎn)錄得到促進(jìn)。
研究結(jié)果表明,NEC可能會導(dǎo)致腺癌或鱗狀細(xì)胞癌。
在NECs的病理中還可以觀察到普通腺癌和鱗狀細(xì)胞癌,當(dāng)其成分超過30%時,被稱為神經(jīng)內(nèi)分泌-非神經(jīng)內(nèi)分泌混合性腫瘤(MiNEN)。 到目前為止,大多數(shù)MiNENs被認(rèn)為是腺癌或鱗狀細(xì)胞癌,分化成神經(jīng)內(nèi)分泌NECs。 然而,在這項研究中,通過比較兩種成分的基因組畸變,研究人員觀察到的結(jié)果表明,NECs可能積累了額外的基因畸變,導(dǎo)致腺癌和鱗狀細(xì)胞癌。
NETs表現(xiàn)出與NEC完全不同的發(fā)病機(jī)制
研究人員還證明,NETs的發(fā)展機(jī)制與NEC完全不同,在NEC的大多數(shù)病例中沒有觀察到RB1基因的異常情況。 NETs沒有在大多數(shù)NECs中觀察到的RB1基因異常,并且比NECs有更少的基因突變,有突變的主要基因是MEN1、DAXX和VHL基因。 有趣的是,大約40%的胰腺NETs發(fā)生了大量的染色體水平缺失(1、2、3、6、8、10、11、15、16、21和22號染色體),這些病例中大約三分之二有MEN1基因的突變。
MEN1基因編碼一種叫做Menin的蛋白質(zhì),已知它參與了染色體結(jié)構(gòu)的維護(hù)和DNA修復(fù)。 這些發(fā)現(xiàn)表明,MEN1突變可能在細(xì)胞分裂過程中破壞了染色體分離機(jī)制的穩(wěn)定性,導(dǎo)致了這種現(xiàn)象。
此外,他們發(fā)現(xiàn),當(dāng)NETs從G1和G2發(fā)展到G3時,會積累基因異常,如TP53和CDKN2A。
界定新的亞組,促進(jìn)藥物重新定位和新藥開發(fā)
該研究結(jié)果在全基因組水平上闡明了胃腸道NEC這一罕見的難治性癌癥的發(fā)生和發(fā)展機(jī)制。NEC的基因組異常與同一器官來源的常規(guī)癌癥(腺癌和鱗狀細(xì)胞癌)不同,而且很少有基因異常可以被現(xiàn)有的藥物如分子靶向藥物所針對。 這也是一種目前難以治愈的癌癥。 該研究小組說:"通過詳細(xì)分析復(fù)雜多樣的發(fā)病機(jī)制,并根據(jù)致癌機(jī)制定義新的亞組,我們希望能促進(jìn)正在開發(fā)的分子靶向藥物的藥物重新定位和新藥開發(fā)。


